Camila Harumi Kimura
Orientadora: Profa. Dra. Mari Cleide Sogayar
Supervisora: Isaura Beatriz Borges Silva
O diabetes mellitus (DM) é uma doença metabólica caracterizada ou pela completa deficiência na produção de insulina (diabetes mellitus tipo 1 – DM1) ou à incapacidade do organismo de utilizar adequadamente esse hormônio (diabetes mellitus tipo 2 – DM2), ambos levando ao aumento dos níveis de açúcar (glicose) no sangue. A hiperglicemia é o principal quadro apresentado pelos pacientes portadores de DM e, se não controlado, pode provocar complicações crônicas, como nefropatia, doenças cardiovasculares (infarto agudo do miocárdio, acidente vascular cerebral e doença arterial periférica), retinopatia e neuropatia diabética.
A insulinoterapia, principal forma de tratamento para pacientes portadores de DM1, na maioria das vezes, não é capaz de manter o perfeito controle dos níveis glicêmicos, (Diabetes Control and Complications Trials Research Group – DCCT, 1993). Fisiologicamente, a restauração das funções da célula β-pancreática através de transplante de tecido produtor de insulina (pâncreas inteiro ou ilhotas pancreáticas) pode ser a melhor opção terapêutica. No entanto, o transplante de pâncreas órgão inteiro é uma intervenção cirúrgica de grande porte, a qual requer um regime imunossupressor muito rígido, sendo recomendado apenas para pacientes que precisam de um transplante renal e dependem do funcionamento adequado do pâncreas para o sucesso do tratamento (Leal-Lopes, 2018). Assim, o transplante de ilhotas pancreáticas, introduzido no Brasil por nosso grupo de pesquisa (Eliaschewitz et al., 2004; 2009), mostrou-se uma alternativa interessante ao transplante de pâncreas inteiro, uma vez que é um procedimento mais simples e menos invasivo. Todavia, a baixa disponibilidade de doadores de pâncreas e a dificuldade na manutenção e sobrevivência das ilhotas em cultura após o isolamento são pontos limitantes ao transplante de ilhotas.
Em vista da necessidade de prospectar novas intervenções terapêuticas para o tratamento do DM1, diversas pesquisas têm buscado metodologias que permitam a expansão de célula β in vitro e viabilizem o aumento do suprimento de células produtoras de insulina (IPCs – Insulin-Producing Cells) para a terapia de reposição das ilhotas pancreáticas. Uma abordagem promissora para superar a dependência de células β-pancreáticas humanas para o transplante de ilhotas pancreáticas consiste na diferenciação de células-tronco em células produtoras de insulina (Lojudice; Sogayar, 2008).
Diferentes estratégias de obtenção de células tipo-β produtoras de insulina têm sido adotadas por diversos grupos de pesquisa no Mundo. O Grupo NUCEL tem buscado o estabelecimento de um protocolo de diferenciação capaz de gerar células produtoras de insulina funcionais e em grande número (Lojudice, 2008; Kossugue, 2013; Leal-Lopes, 2018). Sendo assim, o presente projeto visa, a partir do protocolo estabelecido pelo nosso grupo, otimizar o processo de diferenciação de células-tronco embrionárias murinas (mESCs) em células produtoras de insulina (IPCs) para o tratamento do DM1. Para tanto, será utilizado os fatores peptídicos de crescimento/diferenciação BMP-7 (Bone Morphogenetic Protein 7) e PDGF-BB (Platelet-Derived Growth Factor-BB), produzidos em nosso laboratório. O interesse em empregar estes fatores e avaliar seus efeitos durante o processo de diferenciação in vitro baseia-se no potencial mitogênico do PDGF-BB (CHEN et al., 2011) e na capacidade do BMP-7 induzir a diferenciação de células não-endócrinas em células endócrinas (KLEIN et al., 2015; QADIR et al., 2018).
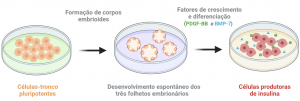
Figura 1: Diferenciação de células-tronco pluripotentes em células produtoras de insulina através da aplicação de fatores de crescimento e diferenciação que participam da organogênese pancreática.
Referências:
Chen, H; Gu, X; Liu, Y; Wang, J; Wirt, SE; Bottino, R; Schorle, H; Sage, J; Kim, SK. PDGF signalling controls age-dependent proliferation in pancreatic β-cells. Nature. 2011 Oct 12;478(7369):349-55.
Eliaschewitz, FG; Aita, CA; Genzini, T; Noronha, IL; Lojudice, FH; Labriola, L; Krogh, K; Oliveira, EM; Silva, IC; Mendonça, Z; Franco, D; Miranda, MP; Noda, E; de Castro, LA; Andreolli, M; Goldberg, AC; Sogayar, MC. First Brazilian pancreatic islet transplantation in a patient with type 1 diabetes mellitus. Transplant Proc. 2004 May; 36(4): 1117-8. 2004.
Eliaschewitz, FG; Franco, DR; Mares-Guia, TR; Noronha, IL; Labriola, L; Sogayar, MC. Islet transplantation as a clinical tool: present state and future perspectives. Arq Bras Endocrinol Metabol. 2009 Feb; 53(1): 15-23. Review. Portuguese. 2009.
Klein, D; Álvarez-Cubela, S; Lanzoni, G et al., 2015. BMP-7 induces adult human pancreatic exocrine-to-Endocrine conversion. Diabetes 64, 4123–4134.
Kossugue, P. M. Diferenciação de células-tronco embrionárias murinas (mESCs) em células produtoras de insulina (IPCs) e caracterização funcional do gene Purkinje Cell Protein 4 (Pcp4) neste processo. 142f. Tese de Doutorado – Instituto de Química, Universidade de São Paulo, mai. 2013.
Leal-Lopes, C. Terapias alternativas para o Diabetes Mellitus tipo 1: caracterização funcional do gene Txnip na diferenciação β-pancreática e desenvolvimento de biomaterial inovador para microencapsulamento celular. 203f. Tese de Doutorado – Instituto de Química Universidade de São Paulo, jun. 2018.
Lojudice, FH. Identificação de genes diferencialmente expressos durante diferenciação de células-tronco e caracterização de células progenitoras mesenquimais. 173f. Tese de Doutorado em Ciências Biológicas (Bioquímica) – Instituto de Química, Universidade de São Paulo, 2008.
Lojudice, FH; Sogayar, MC. Células-tronco no tratamento e cura do diabetes mellitus. Ciência & Saúde Coletiva, v. 13, n. 1, p. 19-21, 2008.
Qadir, MMF; Álvarez-Cubela, S; Klein, D et al., 2018. P2RY1/ALK3-expressing cells within the adult human exocrine pancreas are BMP-7 expandable and exhibit progenitor-like characteristics. Cell Rep. 22, 2455–2468.
The Diabetes Control and Complications Trials (DCCT) Research Group. Hypoglycemia in the Diabetes Control and Complications Trial. Diabetes, v. 46, n. 2, p. 271-286, fev. 1997.

